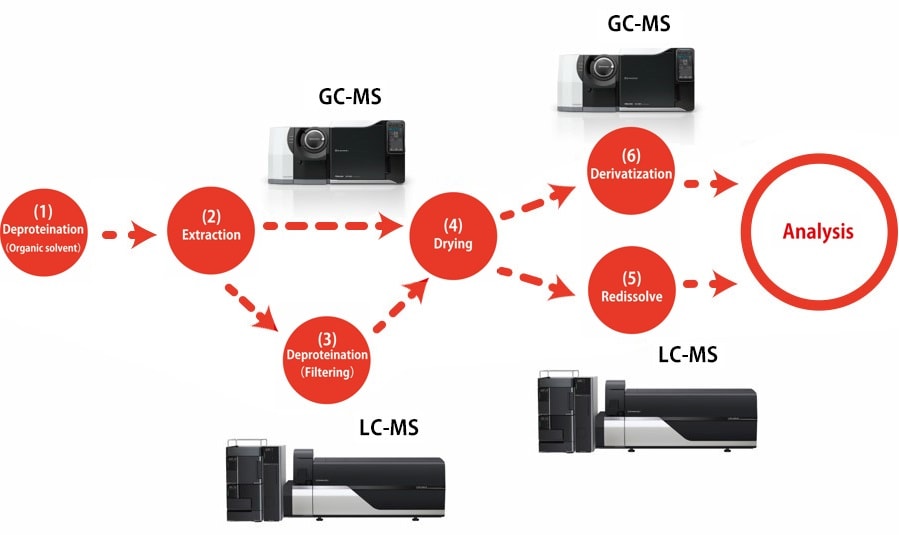
Pretreatment Procedure for metabolomics (Biological sample)
Procedimento de pré-tratamento para o soro sanguíneo
Aqui você encontrará uma visão geral dos procedimentos de pré-tratamento para determinar metabólitos primários no soro usando GC-MS ou LC-MS. Consulte o "Manual de procedimentos de pré-tratamento para análise de metabólitos" para obter detalhes sobre os reagentes e equipamentos experimentais utilizados.
Este método*1 é usado para extrair principalmente metabólitos hidrofílicos adicionando um solvente de extração que consiste em uma mistura de água, metanol e clorofórmio para desproteinizar a amostra líquida e depois recuperar a camada de água. Como apenas os compostos vaporizados são detectados pela análise por GC-MS, os compostos que não vaporizam facilmente devem ser derivatizados. A derivatização é realizada em duas etapas por metoximação e trimetilsililação (TMS).
(1) Desproteinação com solvente orgânico
Colete uma amostra de 50 μL de soro sanguíneo em um tubo de 1,5 mL (Fig. 1). Se for utilizado um padrão interno, adicione o padrão interno ao tubo. Adicione uma certa quantidade de mistura de solventes contendo água, metanol e clorofórmio na proporção de 1:2,5:1 (solvente de extração) ao tubo. Quando a proteína desnatura, o conteúdo do tubo adquire uma cor branca turva (Fig. 2). É conveniente que o solvente de extração possa ser preparado antecipadamente em grandes quantidades e armazenado em frascos de reagentes de 1 L, ou outros recipientes, à temperatura ambiente. O solvente de extração também pode ser adicionado ao tubo após pré-misturar com a solução de padrão interno em um tubo de 50 mL. Depois de misturar bem com um misturador vórtex (Fig. 3), aqueça a mistura a 37 graus Celsius e agite durante 30 minutos a cerca de 1.200 rpm num agitador aquecido (Fig. 4). Ao terminar de agitar, centrifugue a mistura por três minutos a 4 graus Celsius e 16.000 G (Fig. 5). A solução é separada em duas camadas, com a proteína desnaturada precipitada na superfície limite entre as camadas (Fig. 6). Obtenha 225 µL do sobrenadante inserindo cuidadosamente a ponta da pipeta no tubo, de forma que a ponta não entre em contato com o precipitado ou a camada de clorofórmio, e coloque-a em um novo tubo (Fig. 7).

(2)Extração de metabólitos hidrofílicos
Adicione uma certa quantidade de água ultrapura ao novo tubo contendo o sobrenadante recuperado. As proteínas que ainda permanecem na solução são desnaturadas, tornando a solução uma cor branca turva (Fig. 8). Após misturar bem em um misturador vortex (Fig. 9), centrifugue novamente a mistura por três minutos a 4 graus Celsius e 16.000 G. Após centrifugar (Fig. 10), obtenha o sobrenadante e coloque-o em um novo tubo (Fig. 11). ).

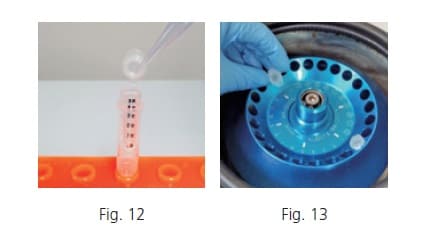
(3) Desproteinação usando filtro de exclusão de tamanho (apenas no caso de LCMS)
Na análise LC-MS, o solvente orgânico é aplicado como fase móvel, expondo a amostra a um ambiente concentrado de solvente orgânico durante a análise. Se proteínas que não foram totalmente desproteinizadas precipitarem durante a análise, isso poderá causar bloqueio de linha que interromperá a análise. Para evitar essa situação, a filtração por exclusão de tamanho é utilizada após a extração para eliminar proteínas. Para remover as proteínas desnaturadas entre as camadas, coloque o filtro de exclusão de tamanho em um tubo limpo (Fig. 12), adicione uma certa quantidade do sobrenadante na parte superior do filtro e feche a tampa. Centrifugar 60 minutos a 4 graus Celsius e 16.000 G (Fig. 13). Após a centrifugação, retire o filtro do tubo.
(4) Secagem
Faça dois ou três pequenos furos na tampa do tubo de 1,5 mL e corte a tampa do tubo (Fig. 14). Coloque a tampa no tubo que contém o sobrenadante coletado (Fig. 15). Utilize o evaporador centrífugo para evaporar o metanol da solução durante 25 minutos (Fig. 16). Após evaporar por 25 minutos, coloque o tubo no freezer sem trocar a tampa. Deixe descansar por cerca de 15 minutos e depois confirme se a solução está totalmente congelada. Por fim, seque no liofilizador (Fig. 17). Se for necessário armazenar a amostra após o pré-tratamento, armazene a amostra seca no freezer para a amostra de análise LC-MS e armazene-a no dessecador à temperatura ambiente para a amostra de análise GC-MS. Isso ocorre porque a derivatização é necessária para análise por GC-MS e a eficiência de dessorção diminui quando a umidade é absorvida.

(5) Redissolver (apenas no caso de LCMS)
(6) Derivatização (somente o caso do GCMS)
Pesar o cloridrato de metoxiamina. Dissolva o cloridrato de metoxiamina pesado em piridina para obter uma concentração de 20 mg/mL (Fig. 20). Prepare solução suficiente de metoxiamina-piridina para o determinado número de amostras envolvidas, assumindo que 80 μL são usados por tubo.
* O cloridrato de metoxiamina pode ser difícil de dissolver em alguns casos. Se resíduos não dissolvidos forem visíveis, use um sonicador ou outro meio para garantir que estejam completamente dissolvidos.
Uma substância sólida com uma cor branca a amarelo esbranquiçada ficará aderida às paredes do tubo de amostra após a liofilização (Fig. 21). Adicione 80 μL da solução de metoxiamina-piridina 20 mg/mL (Fig. 22) e misture no sonicador até que o resíduo esteja disperso (Fig. 23).
* Qualquer umidade contida na amostra diminuirá a eficiência da derivatização, portanto, tome cuidado especial para evitar a entrada de água na amostra
Aqueça e agite a amostra no agitador aquecido durante 90 minutos a 30 graus Celsius e cerca de 1.200 rpm (Fig. 24). Em seguida, adicione 40 µL de MSTFA (Fig. 25) e aqueça e agite a amostra no agitador aquecido por mais 30 minutos a 37 graus Celsius e cerca de 1.200 rpm. Se permanecer algum resíduo, centrifugue a 16.000 G durante três minutos (Fig. 26), recolha o sobrenadante num frasco de GC-MS e utilize-o para análise (Fig. 27).